|
ВОДОРАСТВОРИМЫЕ ФЕНОЛЬНЫЕ СОЕДИНЕНИЯ ЛИШАЙНИКА PELTIGERA APHTHOSA (L.)Willd. Николаева Т.Н., Заварзина А.Г.*, Лапшин П.В., Заварзин А.А.** , Загоскина Н.В.Институт физиологии растений РАН, Москва, ул. Ботаническая, 35, e-mail: phenolic@ippras.ru *Московский государственный университет, почвенный факультет ** С-Петербургский государственный университет, биологический факультет. Лишайники являются симбиотическими организмами, представляющими собой ассоциацию гриба (обычно аскомицета) и фотобионта (водоросль и/или цианобактерия). Наличие фотосинтезирующего партнера позволяет им заселять практически полностью лишенные органического вещества субстраты, а наличие ряда морфологических и химических приспособлений - не только выживать в условиях стресса, но и быстро восстанавливать метаболическую активность [1, 2]. Важнейшей биосферной функцией лишайников считается их участие в первичном почвообразовании, а именно: в образовании мелкозема за счет выветривания массивных горных пород [3] и образовании гумуса (органического вещества почв) за счет накопления на поверхности горных пород лишайниковых метаболитов и продуктов деструкции талломов. Специфическими устойчивыми соединениями гумуса являются гуминовые вещества, определяющие плодородие почв. Они представляют собой высокомолекулярные полидисперсные соединения, которые образуются в ходе частичной окислительной трансформации высокомолекулярных компонентов растительных тканей или за счет полимеризации по свободнорадикальному механизму низкомолекулярных фенольных и азотсодержащих предшественников [4]. В лесных почвах к основным предшественникам гуминовых веществ относят лигнин или продукты его деструкции - фенольные кислоты [5]. Поскольку лишайники не содержат лигнина, при почвообразовании под ними высокомолекулярными предшественниками гуминовых веществ могут быть хитин и меланины, а низкомолекулярными - фенольные соединения, продуцируемые микобионтом. Для лишайников характерен синтез таких специфических вторичных метаболитов, как «лишайниковые кислоты», подавляющее большинство которых не встречаются у других организмов [6, 7]. Эти вещества защищают фотобионт от избыточной инсоляции и действия УФ-излучения [8-10], а также препятствуют поражению таллома различными бактериями и вирусами, поскольку обладают антимикробными свойствами [11]. Лишайниковые кислоты принято относить к фенольным соединениям [12]. По имеющимся в литературе сведениям они считаются практически нерастворимыми в воде [6, 13] и их включение в почвенный гумус представляется возможным лишь после деструкции отмерших частей талломов. Что же касается собственно фенольных соединений, то часть из них (особенно наиболее простые формы) достаточно хорошо растворимы в воде [14]. Но синтезируются ли они в лишайниках и, если да, то могут ли они поступать в почву из живых талломов до сих пор не ясно. В данной работе предпринята попытка получения водорастворимых фенольных соединений из лишайника Peltigera aphthosa и изучения их свойств. МЕТОДЫ ИССЛЕДОВАНИЯ Объектом исследования являлся лишайник Peltigera aphthosa L., собранный на Кольском полуострове (Хибины) и воздушно высушенный. Как показали наши предварительные исследования содержание в нем экстрагируемых спиртом фенольных соединений было в 2-5 раз выше, чем у других родов лишайников. Целые и измельченные талломы лишайника экстрагировали водой. Содержание фенольных соединений в экстрактах определяли спектрофотометрическим методом с реактивом Фолина-Дениса [15]. Калибровочную кривую строили по п-оксибензойной кислоте. Состав фенольного комплекса исследовали методом тонкослойной хроматографии на стеклянных пластинках, покрытых микрокристаллической целлюлозой ("Ferak", Германия; толщина слоя 0,25 мм), используя систему растворителей н-бутанол-уксусная кислота-вода (4:1:5, верхняя фаза). Предварительную идентификацию фенольных соединений проводили на ультрахемископе DESAGA UVIS (ЅDESAGAЅ, Голландия) по специфической ярко-голубой или синей флуоресценции в УФ-свете (длина волны 254 и 366 нм). Для более точной идентификации фенольных соединений хроматограммы сканировали на денситометре (Densitometer CD 50, Desaga, Heidelberg) при длинах волн 280 и 330 нм, соответствующих средним значениям основных максимумов поглощения фенольных соединений. После сканирования одну часть хроматограмм обрабатывали реагентом на сумму фенольных соединений (смесь 1% растворов FeCl3 и K3Fe(CN)6, 1:1), а другую - специфическим реагентом на фенолкарбоновые кислоты (диазотированный п-нитроанилин, с последующей обработкой 20% раствором Na2CO3) [16]. На рисунках представлены типичные денситограммы и хроматограмма водных экстрактов из Peltigera aphthosa. Приведенные в таблице данные получены на основании представленных хроматограммы и денситограмм (рис. 1-3). Таблица 1
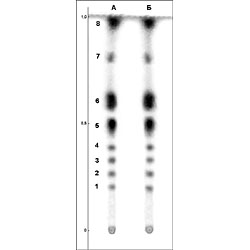
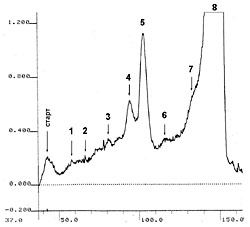
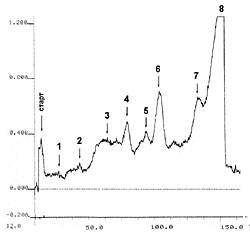
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ Фенольные соединения относятся к одним из наиболее распространенных в растениях представителей вторичного метаболизма. Существует даже представление о том, что они синтезируются практически во всех клетках [17]. Ввиду разнообразия строения фенольных соединений, их выделение одним или двумя простыми методами является практически невозможной задачей. В тоже время известно, что часть из них растворимы в воде, что и послужило основанием для предварительной оценки «извлекаемости» фенольных соединений из таллома лишайника Peltigera aphthosa L. Эта задача представляла несомненный интерес, поскольку в литературе данные о водорастворимых фенольных соединениях лишайников отсутствуют. Определение суммарного содержания растворимых фенольных соединений в водных экстрактах, полученных из измельченных и целых талломов, показало почти двукратные различия (11,4 и 6,1 мг/г сухого веса, соответственно). Это свидетельствует о том, что, во-первых, в лишайниках присутствуют водорастворимые фенольные соединений, а, во-вторых, они достаточно легко «вымываются» из целых талломов. Несмотря на значительную разницу в содержании фенольных соединений в водных экстрактах, полученных из целых и измельченных талломов, их качественный состав был практически одинаков и включал 8 соединений фенольной природы (рис. 1, Rf соответствующих веществ указаны в таблице). Это также позволяет предположить, что при поступлении атмосферной влаги на лишайники, в том числе в виде дождя и снега, может происходить постепенное вымывание фенольных соединений из таллома и последующее их поступление в почву. Далее нами был исследован состав водорастворимого фенольного комплекса, извлекаемого из измельченного таллома лишайника, в связи с более высоким содержанием в нем веществ. Основными его компонентами являлись фенолкарбоновые кислоты, о чем свидетельствовало наличие специфической окраски, возникающей при обработке хроматограмм диазотированным п-нитроанилином (данные не представлены). По всей вероятности, фенолкарбоновые кислоты присутствуют в талломах в виде конъюгатов, поскольку значения их Rf не совпадали с таковыми метчиков и судить об их наличии в экстрактах можно только по идентичности окраски с метчиками. На этом основании можно предварительно предположить присутствие в водных экстрактах таллома лишайника Peltigera aphthosa L. конъюгатов п-оксибензойной и ванилиновой кислот. Факт обнаружения фенолкарбоновых кислот в талломах в конъюгированном состоянии не явился неожиданным, поскольку известно, что в растительных тканях в свободном виде фенолкарбоновые кислоты в значительных количествах не накапливаются, а присутствуют как растворимые и нерастворимые конъюгаты с углеводами, ациклическими и алициклическими кислотами, терпенами, аминами и некоторыми другими веществами [16]. Наличие в водных экстрактах фенолкарбоновых кислот подтверждается также данными денситометрического анализа (рис. 2, 3, см. денситограммы при 280 и 330 нм). Спектры поглощения свободных фенолкарбоновых кислот характеризуются наличием двух максимумов: основного и дополнительного, лежащими в области длин волн 235-305 нм и 300-350 нм, соответственно. Причем вклад в поглощение дополнительного максимума составляет примерно 30% от такого основного. В данной работе нами были выбраны средние значения для основного и дополнительного максимумов - 280 и 330 нм, соответственно. На приведенных денситограммах (рис. 2, 3) видно, что все обнаруженные фенольные соединения (рис. 1) поглощают излучение при обеих длинах волн (280 и 330 нм), но с разной интенсивностью. Площади пиков, отражающих степень поглощения излучения соответствующими веществами, представлены в таблице. Как видно из этих данных, интенсивность поглощения большинства веществ (за исключением таковых с номером 6 и 8) выше при длине волны 280 нм. Это также может свидетельствовать о принадлежности этих веществ к конъюгатам фенолкарбоновых кислот, хотя вклад дополнительного максимума (330 нм) в поглощение и составляет значительно больше, чем 30%. Скорее всего это происходит за счет соединений, конъюгированных с фенолкарбоновыми кислотами. Что касается веществ с номером 6 и 8, то, несомненно, это вещества фенольной природы (рис. 1), но, вероятно, не относящиеся к фенолкарбоновым кислотам, поскольку реакции с диазотированным п-нитроанилином в этом случае не отмечалось. Эти вещества, а также состав конъюгатов, присутствующих в водных экстрактах из талломов лишайника, требуют дальнейших исследований. Суммируя вышеизложенное, можно заключить, что в лишайнике Peltigera aphthosa синтезируются фенольные соединения, часть из которых является водорастворимой. Поэтому вполне возможно их вымывание и из живых талломов под действием дождей и атмосферной влаги. При наличии в первичной почве растворимых фенольных субстратов и фермента (лакказа), о чем сообщалось ранее [18], процесс формирования органического вещества первичной почвы может происходить не только за счет отмерших участков талломов, но и за счет водорастворимых соединений фенольной природы, прижизненно образующихся в лишайниках. ЛИТЕРАТУРА
| Внимание! Эта статья опубликована, на нее можно ссылаться при написании научных работ. Ссылка на эту публикацию выглядит так: Николаева Т.Н., Заварзина А.Г., Лапшин П.В., Заварзин А.А., Загоскина Н.В. Водорастворимые фенольные соединения Peltigera aphthosa (L) Willd. В сб. Фенольные соединения: фундаментальные и прикладные аспекты (под редакцией Н.В. Загоскиной, Е.Б. Бурлаковой). М.: Научный мир. 2010, С. 145-150. Иллюстрации к этой статье: Рис. 1. Хроматограмма водных экстрактов из измельченных (А) и целых (Б) талломов P. aphthosa, 1-8 соединения, дающие реакцию на фенольные соединения. Рис. 2. Денситограмма водного экстракта таллома P. aphthosa при 280 нм (нумерация пиков соответствует таковой на рис. 1). Рис. 3. Денситограмма водного экстракта таллома P. aphthosa при 330 нм (нумерация пиков соответствует таковой на рис. 1). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(с) Авторские права: перепечатка и копирование материалов разрешена без ограничений с простановкой ссылок на авторов и издание, где опубликован материал.
Copyrights: Non commercial using of these materials is permitted with obligatory informing of the authors and linking to the source.